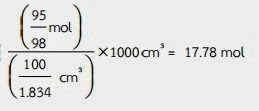1. ในสารละลาย 500 cm3 มี K2SO4 ละลายอยู่ 43.5 g จงคำนวณหาความเข้มข้นในหน่วย ร้อยละโดยมวลต่อปริมาตร และโมลาร์
วิธีคิด ร้อยละโดยมวลต่อปริมาตร
ตอบ สารละลายมีความเข้มข้นร้อยละ 8.7
วิธีคิด โมลาร์
โมลาร์
= จำนวนโมลของตัวถูกละลายในสารละลาย 1 ลิตร (หรือ 1000
cm3)
จากโจทย์
สารละลาย 500 cm3 มี K2SO4ละลายอยู่ 43.5
g ซึ่งคิดเป็น
ดังนั้น
สารละลาย 1000 cm3มี K2SO4 ละลายอยู่
ตอบ สารละลายมีความเข้มข้น
0.5 mol/L
______________________________________________________________________________
2. สารละลาย H2SO4 ขวดหนึ่งเขียนติดข้างขวดว่ามีความเข้มข้นร้อยละ 95 และมีความหนาแน่น
1.834 g/cm3
ถ้าสารละลายนี้มีน้ำเป็นตัวทำละลาย
จงหาความเข้มข้นในหน่วยมวลต่อปริมาตร ,โมลาร์, โมแลลและเศษส่วนโมล
วิธีคิด 1 น้ำหนักโมเลกุล H2SO4 = (2 ×
1) + 32 + (4 × 16) = 98 , H2O = (2 × 1) + 16 = 18
จากโจทย์ สารละลาย H2SO4 เข้มข้นร้อยละ 95 แสดงว่าในสารละลาย 100
g มี H2SO4 ละลายอยู่ 95 g
แต่เนื่องจาก %wt/v = มวลของตัวถูกละลาย
(g) ในสารละลาย 100
cm3
ดังนั้น
ต้องเปลี่ยนหน่วยสารละลายเป็นปริมาตร (cm3) และเทียบกับปริมาตร สารละลาย 100 cm3
ดังนั้น สารละลาย 100 cm3 มี H2SO4 ละลายอยู่
ตอบ สารละลายมีความเข้มข้นร้อยละ 174.23
วิธีคิด 2 สารละลาย H2SO4 ขวดหนึ่งเขียนติดข้างขวดว่ามีความเข้มข้นร้อยละ 95 และมีความหนาแน่น
1.834 g/cm3
ถ้าสารละลายนี้มีน้ำเป็นตัวทำละลาย
จงหาความเข้มข้นในหน่วยมวลต่อปริมาตร
ดังนั้น สารละลาย 1000 cm3 มี H2SO4 ละลายอยู่
ตอบ สารละลายมีความเข้มข้น = 17.78
mol/L
วิธีคิด 3 เปลี่ยนร้อยละโดยมวล เป็น molal หรือ mol/kg
of solvent
จากโจทย์ สารละลาย H2SO4 95 %wt แสดงว่าในสารละลาย
100 g มี H2SO4
95 g และ H2O อยู่ 5 g
แต่เนื่องจาก โมแลล = จำนวนโมลของตัวถูกละลายในตัวท
าละลาย 1 kg (หรือ 1000 g)
ดังนั้นดังนั้นต้องเปลี่ยนหน่วยตัวถูกละลายเป็นจ
านวน โมลและเทียบกับน้ำ 1000
g
ตอบ สารละลายมีความเข้มข้น = 193.88 mol/kg of H2O
______________________________________________________________________________